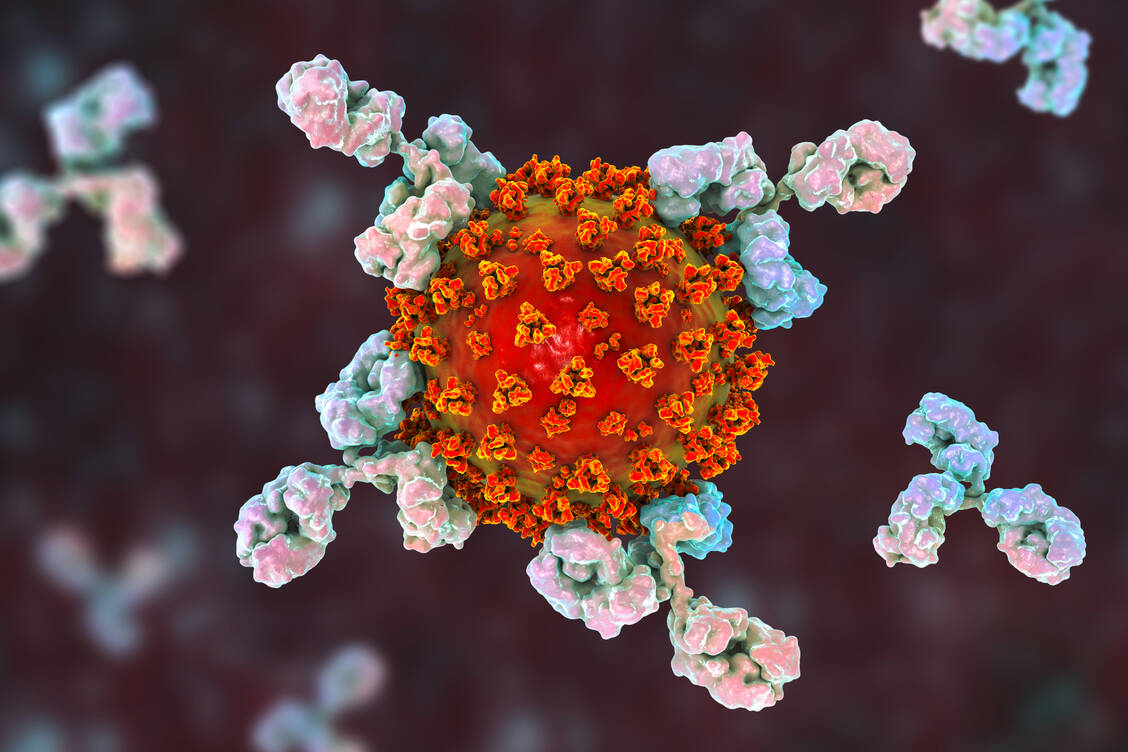
Die neutralisierenden monoklonalen Antikörper richten sich jeweils gegen eine bestimmte Domäne des Spike-Proteins und verhindern nach der Bindung, dass das SARS-Coronavirus-2 in menschliche Zellen eindringt und diese infiziert. Studiendaten weisen darauf hin, dass die Therapie im frühen Krankheitsstadium die Viruslast reduzieren könnte. Laut Paul-Ehrlich-Institut (PEI) sind die Antikörper dementsprechend für Patienten geeignet, die an Covid-19 erkrankt sind, noch keinen Sauerstoff erhalten, aber Risikofaktoren für einen schweren Verlauf haben. Vor dem Hintergrund der Virusvarianten und bei immunsupprimierten Patienten kann es erforderlich sein, zwei verschiedene Antikörper zu kombinieren, um Resistenzen zu umgehen.