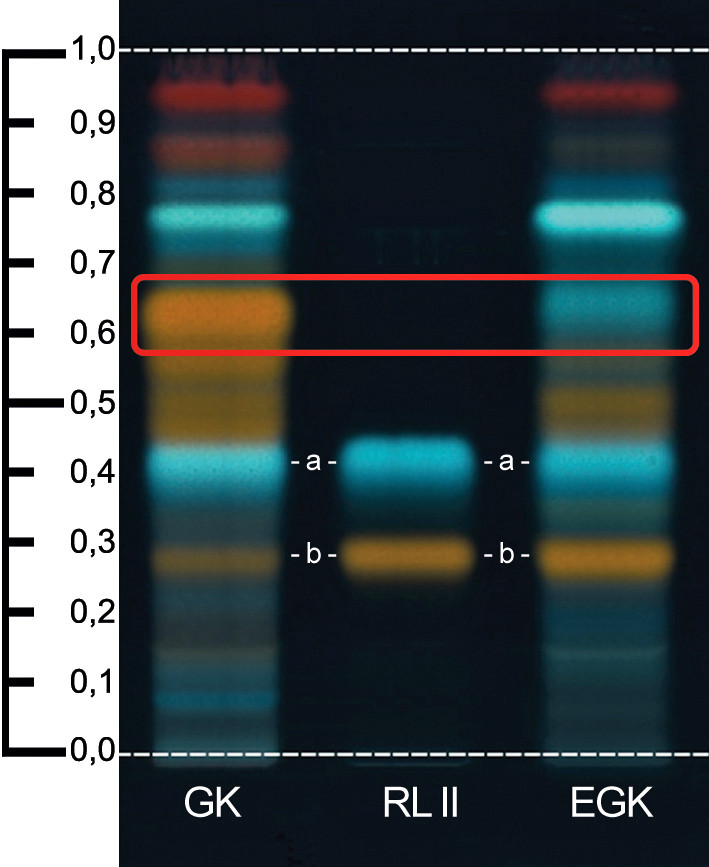
Makroskopisch ist die unterschiedliche Länge der Zungenblüten im Vergleich zu Röhrenblüten ein Unterscheidungsmerkmal. Außerdem enthält Echtes Goldrutenkraut kein Quercitrin. Normalerweise wird dies mit einer Reinheitsprüfung überprüft, jedoch ist es durch das Fehlen der intensiven orange fluoreszierenden Quercitrin-Zone bereits mit der DC der Alternativen Identifizierung möglich, diese Unterscheidung zu treffen (siehe Abbildung). Im Farbteil sind wie gewohnt die farbigen Abbildungen der makroskopischen Merkmale als auch beispielhafte DC-Chromatogramme nach DAC-Probe 10 und 11 von Goldrutenkraut und Echtem Goldrutenkraut zu finden.
Regelhaft war in den letzten Jahren genauso der Zuwachs an farbigen Abbildungen, vor allem von DC-Chromatogrammen. Dass nicht immer eine DC das beste Prüfergebnis im Rahmen der Alternativen Identifizierung bringt, zeigen Natives und Raffiniertes Jojobawachs. Für diese beiden Substanzen entfällt künftig die Prüfung mittels Dünnschichtchromatographie. Dementsprechend entfallen auch die farbigen Abbildungen jener Stoffe weg.